대학원 소식
바이오의공학과 이동택 박사, 정효기 석박사통합과정, 박동성 박사, 윤대성 교수팀 연구결과, ACS Applied Materials & Interfaces 속표지논문 선정
2023.01.04 Views 546
파킨슨병 주원인 물질‘ 알파시뉴클레인 올리고머’ 선택적 분해 가능해져
윤대성 교수팀 연구결과, ACS Applied Materials & Interfaces 속표지논문 선정

▲ 왼쪽부터 고려대 바이오의공학과 이동택 박사(공동 제1저자, 현 Harvard Medical School 박사후연구원), 고려대 바이오의공학과 정효기 석박사통합과정(공동 제1저자), 고려대 바이오의공학과 박동성 박사(공동 제1저자),광운대 전기공학과 이정훈 교수(교신저자), 고려대 생명정보공학과 이규도 교수(교신저자), 고려대 바이오의공학과 윤대성 교수(교신저자)
보건과학대학 바이오의공학과 윤대성 교수 연구팀은 파킨슨병의 병리학적 증상을 일으키는 주원인 물질인 알파시뉴클레인(α-synuclein, αS) 올리고머를 금 나노입자 표면에 아밀로이드 코로나 형태로 코팅하고, 이를 이용하여 αS 올리고머를 선택적으로 분해하는 약물을 발굴할 수 있는 약물 스크리닝 플랫폼을 개발했다.
* 알파시뉴클레인 올리고머 : 알파시뉴클레인 단백질이 응집되어 서로 엉키면서 형성된 중합체
(뇌 알에 알파시뉴클레인 단백질이 존재하고, 이 알파시뉴클레인 단백질들이 서로 엉키고 응집됨으로써 형성됨)
* 아밀로이드 코로나 형태 : 단백질 응집체가 섬유화되어 물체 표면에 층을 이룬 상태로 부착한 형태
(응집되어 섬유화된 단백질이 물체 표면에 달라 붙게 되면, 물체 표면에 하나의 층을 형성하는 것처럼 보이는데, 이를
아밀로이드 코로나로 명칭한다.)
이번 연구결과는 ACS Applied Materials & Interfaces (IF=10.4) 저널에 12월 23일 온라인 공개되었으며 속표지논문으로 선정됐다.
* 논문명 : Biomimetically engineered amyloid-shelled gold nanocomplexes for discovering α-synuclein oligomer-degrading drugs
평균 수명이 증가함에 따라 국내의 고령화 사회가 가속화되고 있으며 2050년 총 예상 인구수 약 4,774만 명 중 65세 이상 노인 인구수는 약 1,900만 명에 이를 것이며, 총인구수의 39.8%로 현재보다 2배 이상 차지할 것으로 예상된다. 가속화되는 고령화 사회에서, 퇴행성 뇌 질환이 있는 인구도 비례하여 증가하고 있다. 2018년 기준 65세 이상 전국 노인 인구 약 750만 명 중 10%에 해당하는 약 75만 명이 퇴행성 뇌 질환 진단을 받은 바 있다.
루이체 치매 및 파킨슨병은 알츠하이머병 다음으로 많은 경우를 차지하고 있는 퇴행성 뇌 질환의 종류이다. 이러한 퇴행성 뇌 질환들은 알파-시뉴클레인(α-synuclein, αS) 단백질의 misfolding protein(단백질 접힘 현상)에 의해 발병되는 것으로 밝혀져 있으며, αS을 대상으로 하는 치료제 개발이 활발하게 진행되고 있다. 최근 연구 결과에 따르면 도파민에 의해 형성된 αS 올리고머가 병리학적 현상의 주원인으로 지목되고 있다.
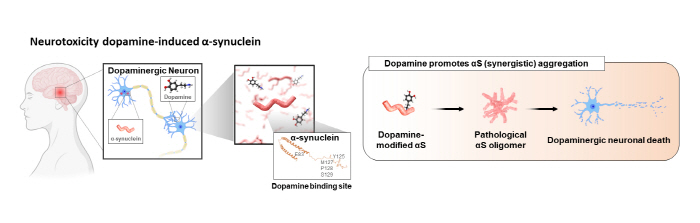
▲ 그림1. 파킨슨병 환자의 뇌에서 병리학적 현상을 일으키는 도파민에 의해 응집된 알파시뉴클레인 올리고머의 모식도
그러나 αS 올리고머는 응집되는 정도가 다양하기 때문에 균일하게 정제하기 어려우며, 올리고머만을 타깃으로 하는 형광염색물질이 부재하기 때문에 약물발굴에 어려움을 겪고 있다. 또한, αS은 고가이고 ($350/25ug) 응집체를 합성하는데 많은 시간 (최소 1주일)이 소요되기 때문에 in vitro 상에서 인위적인 단백질 합성을 하고 약물 개발을 하는 것에는 많은 금전적 비용과 시간이 소요된다.
연구팀은 파킨슨병의 주 원인 물질인 αS 올리고머를 빠르고 균일하게 합성하기 위해 금 나노입자와 도파민을 이용한 방식을 개발하고, 이를 통해 고속으로 αS 올리고머 분해 약물을 스크리닝 할 수 있는 플랫폼을 개발했다. 금 나노입자는 αS 응집체 합성에 촉매 역할을 하며, 기존 단백질 합성 농도보다 100배 이상 적은 농도로만으로도 αS 응집체를 합성할 수 있게 사용됐다. 또한, 금 나노입자 표면에 단백질이 증착시켜 합성함으로써 균일한 크기의 αS 응집체를 형성시키는 방법을 사용했다. 뿐만 아니라, 도파민을 이용하여 생체 내 병리학적 증상을 유발하는 αS 올리고머의 형태를 모방하여 αS-나노입자 응집체 (ASGN)를 제작했다.
이렇게 제작한 αS-나노입자 응집체에 αS 올리고머를 타깃하는 약물(효소 또는 소분자)를 처리하게 되면 금 나노입자 표면의 αS 올리고머가 분해되면서 금 나노입자의 표면이 드러나게 되어 입자의 불안정성을 유발하게 된다. 이는 분산되어 있던 나노입자의 응집을 일으키게 되고, 응집효과에 따라 금 나노입자의 광학적 특성에 변화가 일어나게 되며 용액의 흡광도가 적색이동 (red shift) 하게 된다. 이러한 용액의 색변화 (붉은색보라색)을 관측함으로써 약물의 효능을 정량적으로 평가할 수 있다.
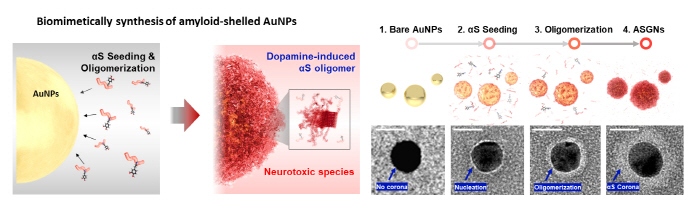
▲ 그림2. αS-나노입자 응집체 합성 모식도
연구팀은 αS 올리고머를 분해할 수 있는 단백질 분해효소들을 이용하여 연구팀의 약물 스크리닝 플랫폼의 유효성을 검증했으며, 뇌 질환에 관련된 16종의 약물에 대한 평가를 진행하였다. 그 결과 기존 αS 올리고머를 분해하는 것으로 알려진 약물들에 대한 추가 검증과 후보 약물들의 αS 올리고머 분해 능력을 비교평가 할 수 있었다.
기존에 형광 또는 단백질의 형상을 이용하여 약물의 효능을 측정하는 방식은 단백질 응집체 합성을 위해 수십 mg의 단백질이 필요로 하며 응집체 합성 시간이 최소 일주일이 걸린다. 또한, 형광 표지를 위한 많은 전처리 과정이 필요로 된다. 하지만 연구팀의 αS 올리고머 분해 약물 스크리닝 플랫폼은 하나의 측정 장비를 이용하여 수 시간 이내에 수천가지의 약물의 효능을 실시간으로 고속 모니터링 할 수 있다. 뿐만아니라, 연구팀의 플랫폼은 복잡한 전처리 과정이 필요로 하지 않으며 하나의 약물의 효능을 측정할 때 필요한 αS의 양이 ~ng 단위이다. 이는 기존의 방식에 비해 매우 효율적이고 경제적으로 약물을 스크리닝 할 수 있는 방식이라 할 수 있다.
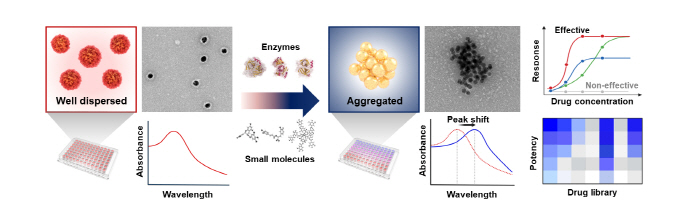
▲ 그림3. αS-나노입자 응집체를 이용한 αS 올리고머 분해 약물 스크리닝 모식도
윤대성 교수팀은 이 약물 스크리닝 플랫폼을 이용하여 난치성 뇌질환 혁신신약개발 바이오업체인 ㈜ 에스트리온과 협업을 통해 파킨슨병 후보 약물 라이브러리에 대한 대량 약물 스크리닝을 진행하고 있으며, 현재 이를 통해 αS 올리고머 분해 약물 후보군 10여종을 발견하였다. 이 약물 후보군들의 αS 응집체 분해능력 추가 검증을 완료한 상황이며, 발굴한 약물을 기반으로 하여 추후 동물 실험을 통하여 파킨슨병 치료제 개발을 위한 전임상 진입을 준비하고 있다. 또한, 윤대성 교수 연구팀은 본 αS 올리고머 분해 약물 스크리닝 플랫폼에서 금 나노입자 표면에 코팅하는 단백질을 변형하며 타우 응집체 분해 약물 스크리닝 플랫폼, COVID-X 치료제 약물 스크리닝 플랫폼 등 다양한 약물 스크리닝 플랫폼으로 영역을 확장해 나갈 예정이다.
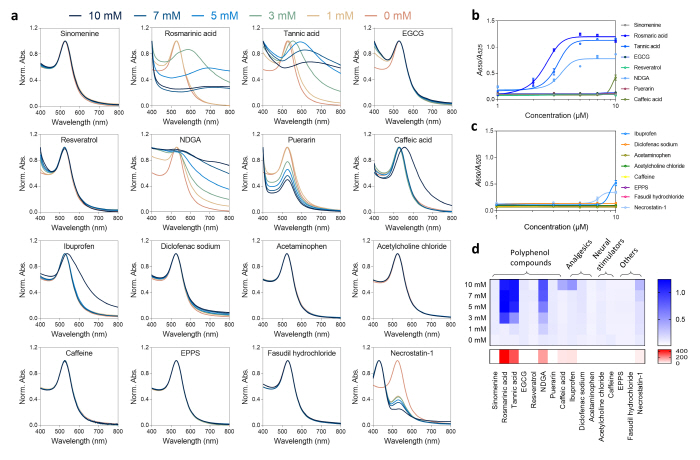
▲ 그림4. 약물 스크리닝 플랫폼을 이용한 약물의 αS 올리고머 분해능력 평가

